1. 기업 개요
에이비엘바이오는 지난 2016년 한화케미칼 바이오사업부 연구진들이 의기투합해 만든 회사다. 이후 설립 2년 만인 2018년 12월 19일에 코스닥시장에 상장되었다.

현재 기반 기술인 이중항체 플랫폼 'Grabody™'를 바탕으로 연구개발하는 다양한 면역항암치료와 퇴행성 뇌질환용(CNS) 치료약물 개발에 선도적 역할을 하고 있는 바이오텍 연구 기업이다. 에이비엘바이오는 난치 질환들을 치료하기 위한 다양한 플랫폼 기술을 보유하고 있다.
상장 전부터 미국 제약기업 트리거테라퓨틱스와 동아에스티, 유한양행 등과 기술이전 계약을 체결하는 등 두각을 나타냈다.

에이비엘바이오 이상훈 대표는 서울대학교 사범대 생물학과에서 학사와 석사 과정을 마치고 미국 오하이오주립대학으로 유학을 떠나 하버드, 스텐포드를 거치며 포닥(포스트닥터, 박사후연구원) 과정을 밟았다.
이후 카이론, 아스트라제네카, 제넨택, 엑셀레시스 등 유수의 글로벌 제약회사 연구원으로 활약하며 항암제 신약 개발에 대한 경험을 쌓았다. 2009년 파멥신을 공동창업하고 2013년에는 한화케미칼에서 바이오사업부 총괄을 역임한 바 있다.
2. 기술 개요 및 기술적 경쟁력
2.1. 기술 개요
에이비엘바이오의 미래가치는 이중항체 플랫폼 기술이다. 이중항체란 하나의 항체가 서로 다른 2개의 항원에 결합하도록 하는 항체단백질이다. 단일항체가 질병을 유발하는 1개의 인자를 인식하는 것과 달리 이중항체는 2개 이상의 인자에 작용하기 때문에 효능이 우수하다. 암 치료를 위해서는 항암제를 섞어 쓰는 병용요법이 사용되곤 하는데 이중항체는 병용요법의 단점인 비싼 가격과 부작용을 보완할 수 있는 기술이다.
또한 확장성이 높은 플랫폼 형태로 이중항체를 개발하고 있어 고형암, 혈액암, 퇴행성 뇌질환 등 여러 질환을 대상으로 하는 다양한 파이프라인을 보유하고 있다. 이들은 다수의 적응증을 대상으로 하는 동일한 기전의 후보물질이 아닌 각 질환에 따라 해당 적응증에 적합한 항체를 붙인 서로 다른 파이프라인이다.
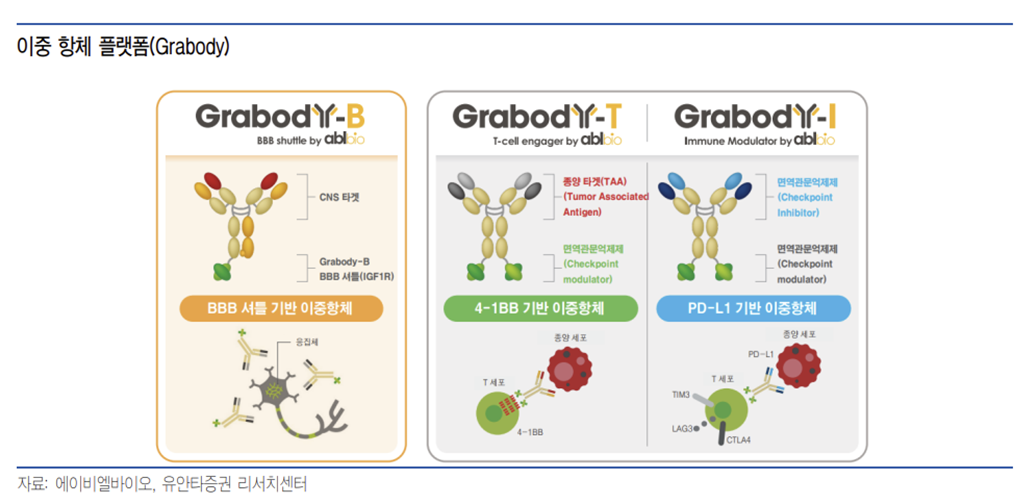
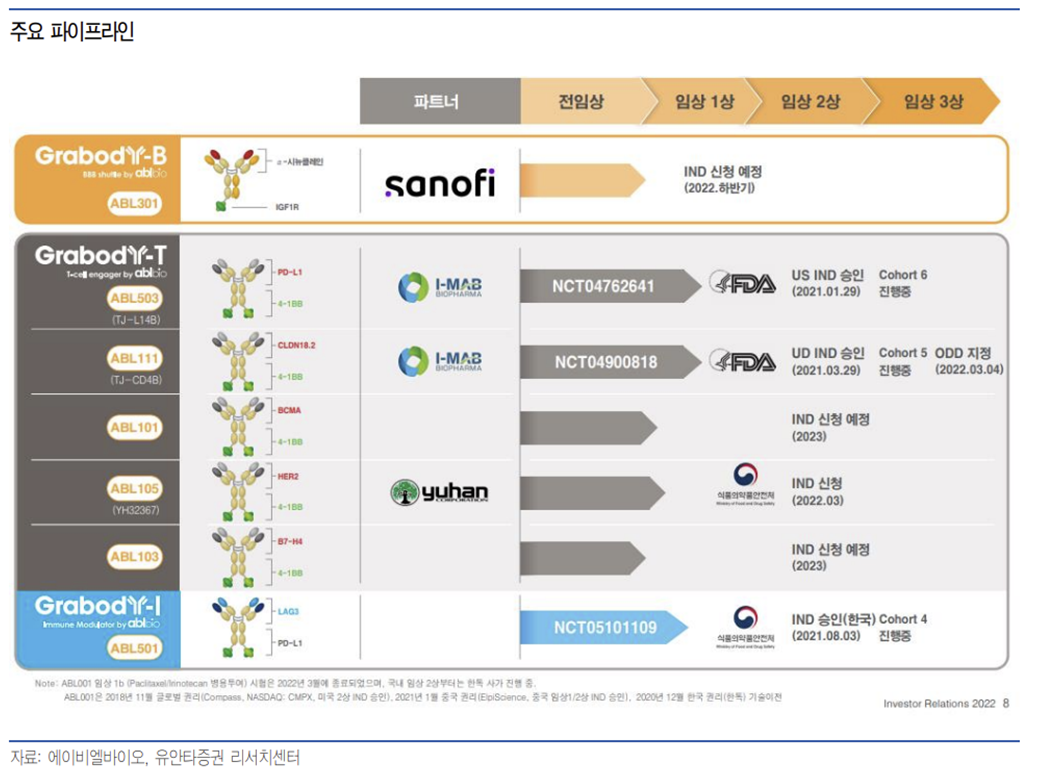
에이비엘바이오는 그랩바디-B, 그랩바디-T, 그랩바디-I 등의 이중항체 플랫폼을 보유하고 있으며, 이를 토대로 항암제와 난치성 뇌질환 치료제 등을 개발 중이다. 현재 7개의 파이프라인을 보유하고 있다.
동사의 기술은 특히 기존 치료제의 한계를 극복할 수 있는 기술이다. 그랩바디-B는 Biogen의 아두카누맙(Aducanumab)과 Eli Lilly의 도나네맙(Donanemab) 등이 직면한 BBB 투과 문제를 BBB 셔틀 타깃을 통해 보완했으며, 그랩바디-T는 종양미세환경에서만 활성화되는 기전으로 4-1BB 단독항체의 간 독성 문제를 해결했다. 그랩바디-I 역시 두 가지 면역관문을 표적함으로써 항암효과를 높이고, 기존 PD-L1 치료제의 내성과 낮은 반응률을 개선했다. 이러한 기술력과 전문성이 에이비엘바이오의 경쟁력이다.
퇴행성 뇌질환 분야에서 에이비엘바이오는 뇌혈관장벽(Blood-Brain Barrier, BBB) 투과율을 높인 이중항체 플랫폼 ‘그랩바디-B(Grabody-B)’를 개발했으며, 이를 기반으로 다양한 중추신경계 질환(CNS)을 타깃으로 하는 파이프라인을 연구 중에 있다.
또한 면역항암 분야에서는 우수한 효능과 안전성이 확인된 4-1BB 기반 이중항체 플랫폼 ‘그랩바디-T(Grabody-T)’와 이를 적용한 파이프라인 ABL503, ABL101, ABL111, ABL105, ABL103 등을 개발 중이다. 아울러 서로 다른 두 개의 면역관문을 억제하는 PD-L1 기반 플랫폼 ‘그랩바디-I(Grabody-I)’와 이를 활용한 ABL501에 대한 연구개발도 진행하고 있다.
신한금융투자에 따르면 글로벌 이중항체 의약품 시장 규모는 2017년 1억8000만달러(약 2027억원) 규모에서 2030년 93억달러(약 10조5000억원)까지 연평균 34%씩 성장할 전망이다.
에이비엘바이오가 중점적으로 진행하고 있는 것은 이중항체 플랫폼 기술을 이용한 항암제 개발이다.
최근 3세대 항암치료제인 면역항암제가 관심받고 있는 상황에서, 이중항체 플랫폼 기술의 미래는 밝다. 단일항체 기반의 면역항암제는 반응률이 15~20%에 불과한 반면, 단일항체보다 높은 결합력과 반응률을 갖춘 이중항체 기반의 면역항암제가 각광받고 있기 때문이다.
항암제 분야에서 가장 진전이 있는 것은 대장암, 위암, 간암, 담도암 치료제로 개발 중인 'ABL001'이다. 올해 말 임상1상 완료를 목표하고 있다. 임상2상은 지난 2019년 에이비엘바이오로부터 국내 개발 및 판권을 넘겨받은 한독이 진행한다. 임상2상에서는 집중적으로 담도암 환자를 대상으로 연구를 진행한다.
일반 고형암 치료제로 개발되고 있는 'ABL503'은 지난 1월 말 미국식품의약국(FDA)으로부터 임상1상 계획을 승인받았다. 이에 따라 에이비엘바이오는 미국 내 임상전문기관 6곳에서 환자 36명을 대상으로 ABL503 단독요법의 내약성과 안전성을 평가한다.
중국 아이맵과 공동 개발 중인 ABL111은 위암과 췌장암 치료제로 임상1상 계획을 FDA에 제출한 상태다.
에이비엘바이오의 이중항체 기술은 최근 난치성 뇌질환 치료 분야에서도 연구가 진행되고 있다.
ABL301은 에이비엘바이오가 파킨슨병 치료제로 개발하는 후보물질이다. 기존 퇴행성 뇌질환 치료제는 혈액뇌관문(BBB)에 막혀 뇌 안으로 제대로 전달되지 못하는 한계가 있지만, ABL301은 '그랩바디-B(Grabody-B)' 플랫폼을 이용해 BBB 투과율을 기존 단독 항체 대비 월등한 수준으로 높여 동물실험에서 효능을 보였다는 평가를 받고 있다.
2.2. 기술 경쟁력 상세
빅파마의 기술 검증을 받은 BBB 셔틀
동사의 뇌혈관 장벽(Brain Blood Barrier, BBB) 셔틀 이중항체 플랫폼 기술인 Grabody-B가 적용된 파킨슨 치료제 파이프라인인 ABL-301을 글로벌 빅파마인 Sanofi에 기술이전 했다.
ABL301은 파킨슨병의 잠재적 병인인 알파-시누클레인을 표적하는 항체와 그랩바디-B 플랫폼을 결합한 이중항체다. 알파-시누클레인은 뇌세포 사이에서 신경전달을 돕는 단백질로, 돌연변이가 생겨 분해되지 않고 응집될 시 신경세포의 사멸을 야기해 파킨슨병과 같은 신경 퇴행성 질병의 원인이 된다.
ABL301은 뇌혈관벽에 존재하는 IGF1 수용체를 통해 뇌 속으로 들어가 신경세포 밖에 뭉쳐져 있는 알파-시뉴클레인 응집체에 선택적으로 결합하게 되고, 항체와 결합한 응집체는 다시 대식세포의 인식 대상이 된다. 이 대식세포가 응집체를 분해함으로써 신경세포 손상을 야기하는 근본적인 병인을 해결할 수 있다.
[*알파-시누클레인 관련 참고 내용]: https://contents.premium.naver.com/hughkim/knowledge/contents/220130021035873Nd
파킨슨병과 알파 시누클레인 단백질
9장 파킨슨병과 알파 시누클레인 단백질 고려대학교 화학과 김준곤, 임동준 이제는 40대 중반인 제가 한창 영화관을 찾던 10대, 20대 때는 지금처럼 멀티플렉스 영화관이 흔하지 않았습니다. 인기
contents.premium.naver.com
총 계약 규모 10억 6,000만 달러, 계약금만 7,500만 달러의 대형 계약으로 일반적인 전임상 단계 파이프라인의 기술 이전에서 계약금이 차지하는 비중이 총 계약 규모의 1~2% 정도인 것과 비교할 때 동사의 파이프라인에 대한 Sanofi의 높은 가치 평가를 확인할 수 있다. 계약금 이외에도 4,500만 달러의 단기 마일스톤 수령이 곧 발생할 예정으로 초기 수령하는 기술 이전료 비중이 매우 높다.

ABL-301 기술이전으로 Grabody -B 플랫폼의 기술에 대한 검증이 완료되었다고 보이며, 임상 진행을 통해 BBB셔틀 기술의 인체 내 작용에 대한 확인 과정만이 남아 있는 것으로 판단한다.
ABL301은 올해 하반기 미국 임상시험계획서(IND) 제출을 목표로 비임상 독성실험(GLP tox study) 등 IND 제출에 필요한 몇 가지 실험을 진행하고 있다. 전임상 시험 결과, ABL301은 알파-시누클레인 응집체에 대한 높은 선택성과 그랩바디-B를 통한 향상된 BBB 투과율로 우수한 PD 효과가 입증됐다.
에이비엘바이오에서는 남은 전임상 연구와 임상 1상까지 주도하고, 이후 진행되는 임상시험부터 상업화까지는 사노피가 담당하게 된다. Grabody -B가 전임상 결과와 같이 인체에서도 유사하게 작용할 수 있는지에 대한 확인시 지속적으로 L/O 계약이 이어질 것으로 기대한다.
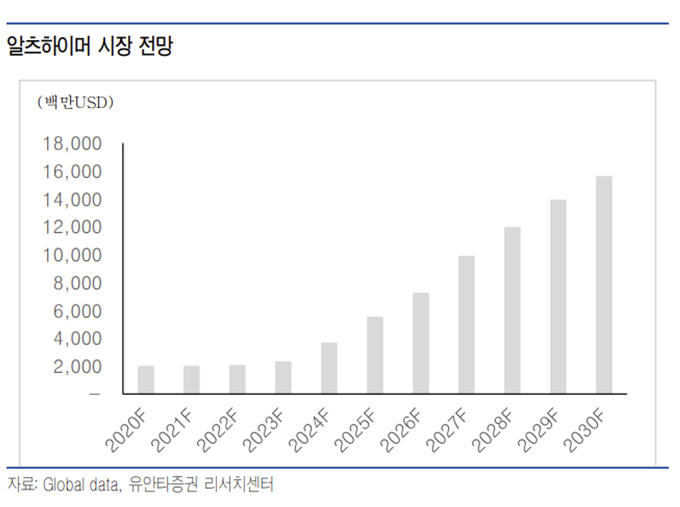
알츠하이머, 파킨슨병과 같은 퇴행성 뇌질환에 대한 시장의 관심이 높으며 바이오젠, 일라이릴리, 로슈 등의 글로벌 수준의 신약 개발 기업들이 lecanemab, donanemab 등의 단클론 항체 를 이용한 치료제 개발이 계속되고 있다. 또한 항암 치료 환자의 생존 기간 증가로 항암제들의BBB 통과에 대한 중요도도 높아지고 있어 동사의 BBB 셔틀 플랫폼이 가지는 기술 확장성은 매우 클 것으로 예상한다.
IGF1R, 비주류에서 주류로
Grabody-B는 뇌혈관장벽 투과율을 높이고 긴 반감기를 통해 기존 단독항체가 가지는 한계인 뇌로의 약물전달률을 높이는 핵심 기술이다. 그랩바디-B는 뇌혈관장벽의 BBB 수용체를 인식할 수 있는 IGF1R 셔틀 타깃을 활용해 RMT(Receptor Mediated Transcytosis)라는 Mechanism을 통해 BBB를 투과한다. IGF1R은 사람의 뇌 미세혈관(BMV)과 뉴런세포에서 특이적으로 더 많이 발현돼 기타 조직 발현으로 야기될 수 있는 off-target 효과를 최소화할 수 있다. 현재 그랩바디-B는 BBB 투과 문제로 약물전달률이 낮은 단독항체 기반 치료제들의 한계를 극복할 수 있는 핵심기술로 글로벌에서 인정받고 있다.
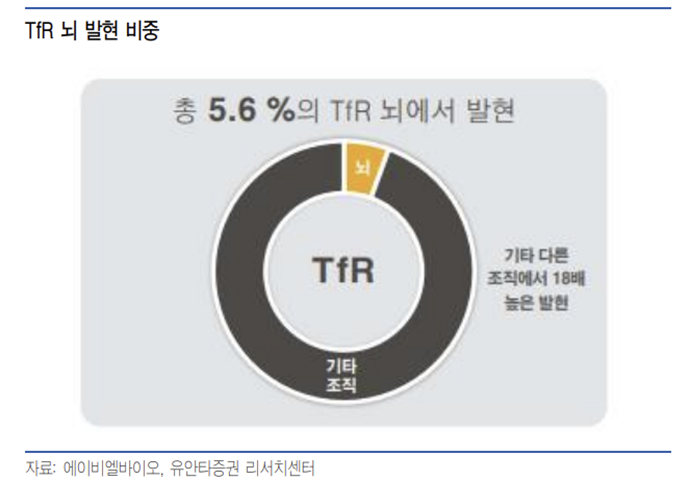
Grabody -B는 IGF1R를 셔틀 타겟으로 사용하는 플랫폼으로 주요 BBB셔틀 개발사들이 사용하는 타겟이 TfR인 것과 비교해서 독특하다. TfR를 타겟으로한 BBB 셔틀은 로슈와 Denali 등이 개발을 하고 있으며 뇌 미세혈관의 수용체 중 발현량이 가장 많은 것으로 알려져 있다. 그러나 TfR은 뇌 이외의 조직에서 더 많은 발현량을 보이고 있고 전체 TfR 발현량 중 5.6%가 뇌에 존재해 뇌 미세 혈관에 특이적으로 발현도가 높은 수용체는 아니다.
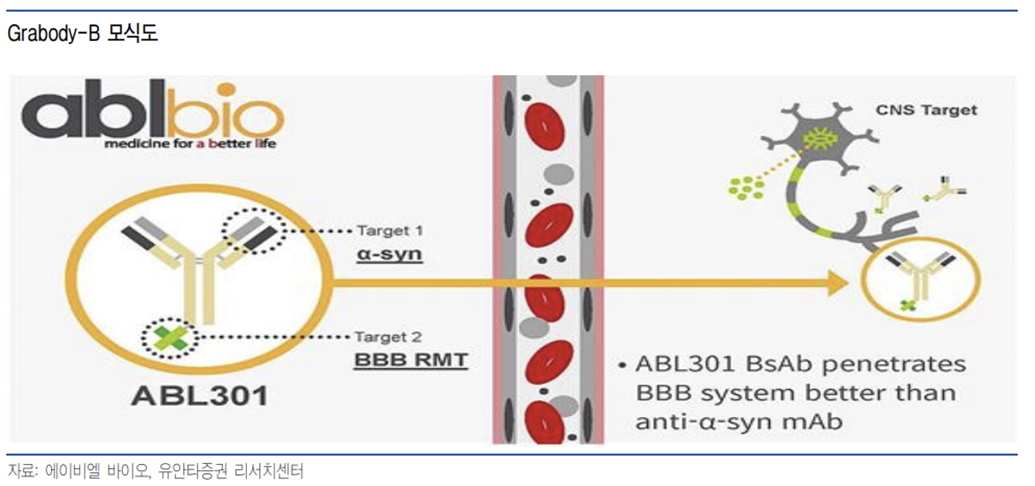
동사가 타겟으로 하는 IGF1R는 TfR에 비해 절대 발현량은 적지만 전체 발현량 중 32.7%가 뇌에서 발현될 정도로 뇌 특이적으로 발현되는 특징이 있어 부작용 위험 등이 낮을 것으로 예상된다.
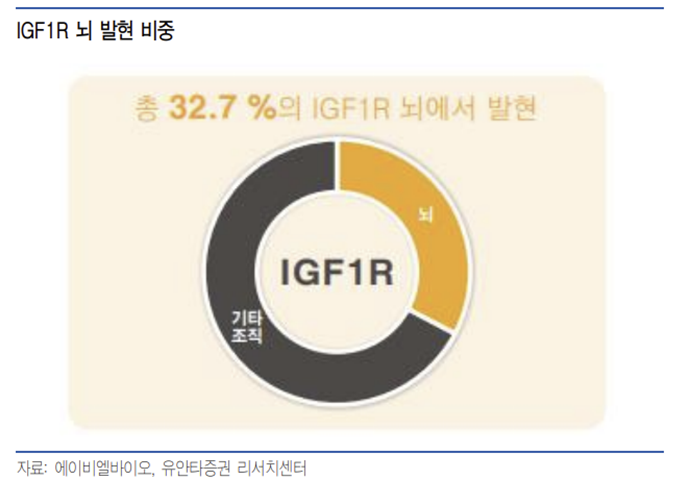
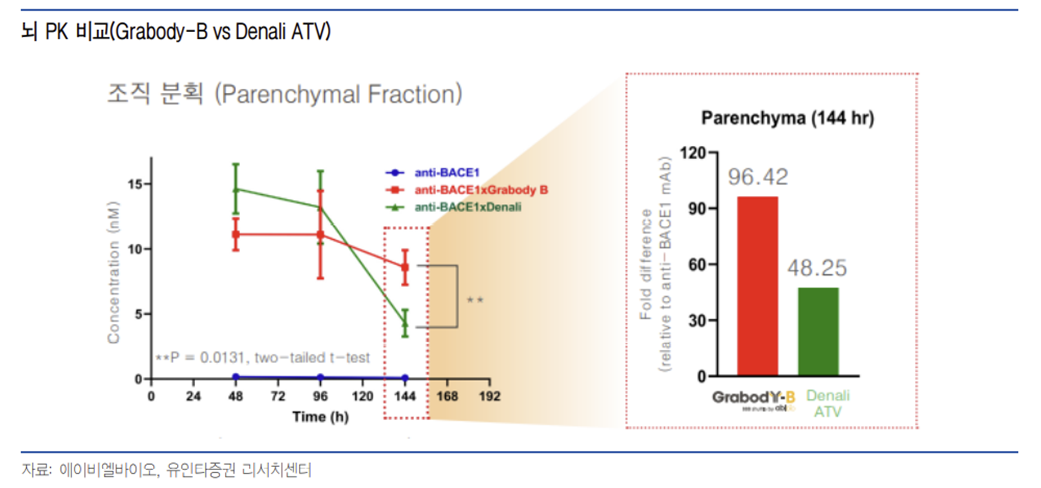
또한 Grabody -B는 경쟁 BBB 셔틀의 반감기가 4일 정도인 것과 대조적으로 10~12일의 반감기를 가지고 있어 약물 투여 간격을 늘릴 수 있는 장점이 있다. TfR을 이용하는 Denali사의 이중 항체 플랫폼과 비교할 때 Grabody -B는 초기 조직 약물 농도는 더 적지만 144시간(6일) 이후부터 더 높은 약물 농도를 유지, 더 긴 반감기를 가지는 것으로 보인다.
새로운 파이프라인 개발에 더해 그랩바디-B 플랫폼을 다른 회사의 항체에 결합하는 연구도 진행하고 있다. 그랩바디-B가 플랫폼인 만큼 확장성이 뛰어나 CNS 질환, 뇌종양, 효소 관련 CNS 질환 등을 표적하는 다양한 항체에 적용할 수 있다.
이중 항체, 4-1BB의 간독성을 피하는 방법
[Grabody-T] 종양에서 발현되는 항원과 4-1BB를 동시에 타깃해 면역세포를 활성화시켜 강력한 항암효과를 나타내며, 4-1BB 단독항체의 주요 문제점인 간 독성을 해결한 플랫폼이다. 원숭이 동물실험 결과, 일시적 또는 영구적 간 독성을 보이지 않았으며, 이를 기반으로 한 모든 파이프라인은 TAA(Tumor Associated Antigen) 발현이 높은 종양미세환경에 국한해 T세포가 활성화돼 안전성이 높은 것이 특징이다.
또한, Grabody -T는 4-1BB 활성 항체와 다양한 종양 표식 인자인 TAA 항체를 결합한 이중 항체 플랫폼이다. 4-1BB는 T-세포를 활성화 하는 분자 중 하나로 T 세포의 분화와 활성을 지속 가능하게 하는 기능이 있어 면역항암제로 urelumab(BMS), utomilumab(화이자) 등이 4-1BB 활성 항체 약물로 개발을 시도했지만 urelumab은 간독성 문제로 임상을 중단했으며, utomilumab은 독성은 적었지만 효능이 부족해 임상을 중단했다.

간에 존재하는 쿠퍼셀(Kupffer cells)이 IL-27 의존 간세포 독성을 자극하여 간독성이 발생하는 것으로 동사의 Grabody -T는 종양 바이오마커 항체와 4-1BB 활성 항체를 결합해 종양 세포가 존재하는 환경에서만 4-1BB 활성 항체가 작용해 간에서는 4-1BB 활성을 하지 않도록 고안되었다. 임상 시험에서 TAA 발현과 4-1BB 활성도가 비례하는 결과를 확인해 4-1BB 활성 항체가 TAA 환경에서만 작용하는 것이 확인 되었으며 원숭이 독성 시험에서도 간독성을 나타내지 않았다는 점에서 간독성을 피할 수 있을 것으로 판단한다.
CD3 이중 항체 시대 개막, 다음은 4-1BB 이중 항체
14년 암젠의 이중 항체 플랫폼인 BiTE를 이용한 블린사이토(Blincyto, blinatumomab) 이후 T cell engager 를 이용한 이중 항체 약물 개발이 이어지지 않았으며 킴리아, 예스카타 등 CAR-T 기술이 적용된 약물들이 상업화에 성공했다.
그러나 상업화에 성공한 CAR-T들은 모두 자가 CAR-T로 환자의 T-세포를 채취해 CAR라고 불리는 종양 세포를 인식할 수 있는 항원 수용체를 결합시킨 후 증식 시켜 환자에게 투약하는 방법이 사용되고 있다. 높은 완전 관해율등의 효능에도 불구하고 개인 고유의 T-세포를 사용하기 때문에 수억원의 고가 약물이며 2~6주 정도의 생산 시간이 필요해 생산 도중 환자가 사망하는 문제 등이 발생할 수 있어 기성품 CAR-T에 대한 필요성은 계속되고 있다.
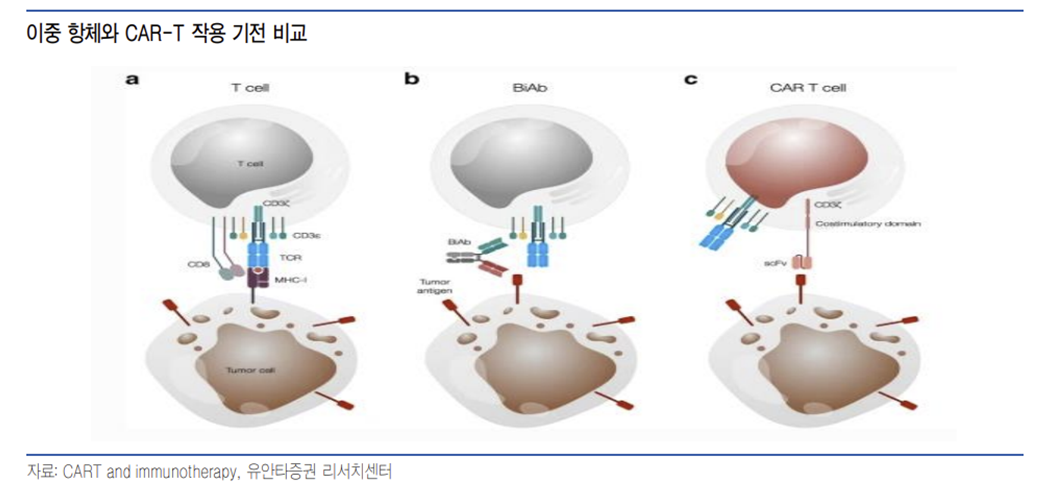
CAR-T와 기전이 유사한 T cell engager가 대안으로 부상하고 있으며 블린사이토 이후 8년 만인 올해 룬수미오(Lunsumio, mosunetuzumab)와 테크베일리(Tecvayli, teclistamab)이 EMA 승인을 받았으며 FDA 승인을 진행 중에 있다. 특히 존슨앤존슨은 다발성 골수종에 대해 카빅티(Carvykti, cilta-cell)과 테크베일리를 허가 받아 CAR-T와 이중 항체를 모두 허가 받았다.
현재까지 허가된 T cell engager 항암제는 모두 CD3 활성 항체를 기반으로 한 이중 항체이며 glofitamab(제넨텍/로슈), epcotarimab(애브비) 등의 상업화가 가까운 이중 항체들도 모두 CD3 기반 이중 항체들이다.
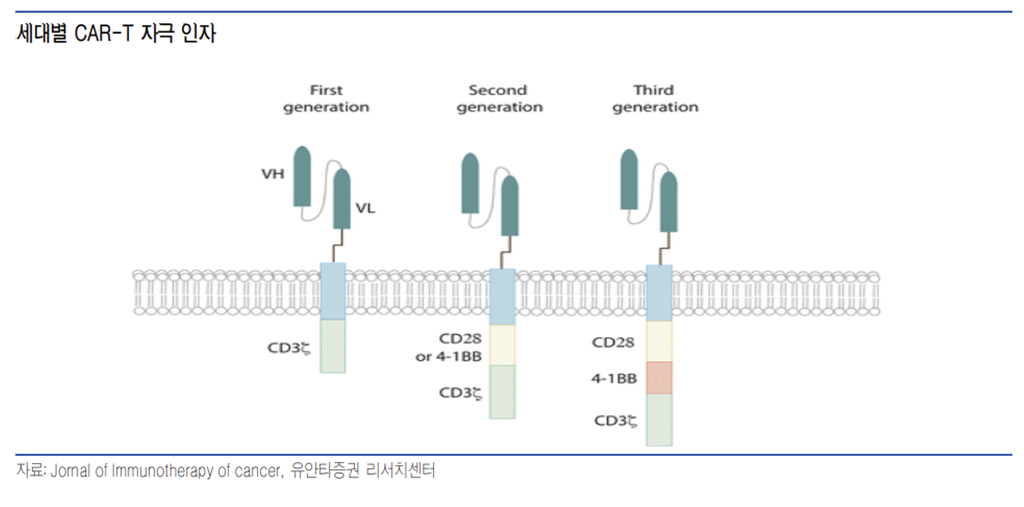
CD3는 T-세포의 초기 활성을 유도해 이중 항체 플랫폼을로 많이 활용되는 타겟이다. 그러나 상업화에 성공한 킴리아, 예스카타 등의 CAR-T 들은 CD3 이외에도 보조 자극 인자로 CD28 또는 4-1BB를 이용하고 있으며 3세대 CAR-T는 CD3/CD28/4-1BB를 자극 인자로 해 CD3 이외의 보조 자극 인자가 중요성이 높아지고 있다.

이중 항체가 기성 CAR-T가 되기 위해서는 T-세포의 초기 활성을 자극하는 CD3 이중 항체와 장기적인 T-세포 활성을 유지시켜주는 보조 자극인자(4-1BB 또는 CD28) 이중 항체 병용에 대한 관심이 높아지고 있다. 현재 CD3 이중 항체의 상업화에 성공하고 있으며 이후에는 4-1BB 또는 CD28 이중 항체 파이프라인으로 빅파마들의 관심이 옮겨질 것으로 판단한다.
면역 기억 효과와 TAA low에서의 가능성
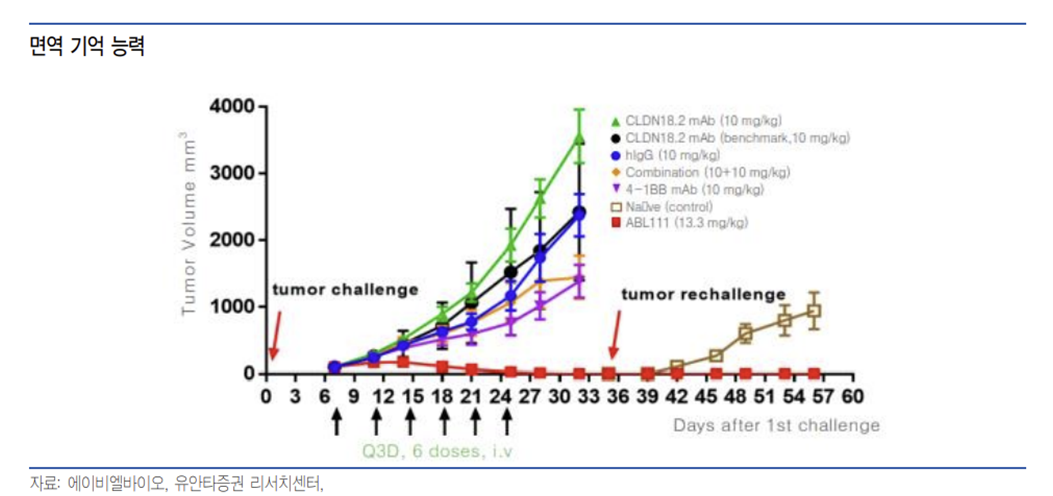
Grabody -T는 종양 특이적 면역 항암 작용뿐만 아니라 면역 기억 능력을 통해 장기간 항암 작용이 지속될 수 있을 것으로 기대된다. 마우스 대상 종양 이식 시험에서 ABL111 투약 이후 종양이 사라지는 완전 관해 결과를 보였으며 종양 세포를 재이식한 이후에도 종양을 억제하는 장기 지속 효과를 보여 잔존 미세 질환 등으로 인한 재발 위험성 등을 낮출 것으로 기대하며, 특히 혈액암은 재발 위험성을 평가하는 미세잔존질환에 대한 중요도가 높아지고 있다는 측면에서 중요한 지표로 생각한다.
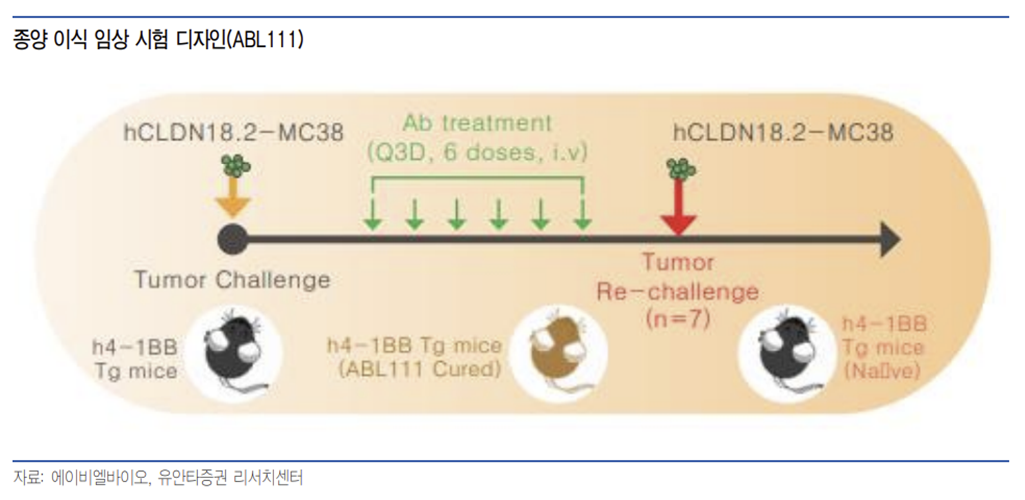
동사의 Grabody -T도 TAA 저발현 환자군에서 효과를 보일 수 있을 것으로 동사가 I-MAB과 공동 개발 중에 있는 ABL111은 4-1BB/CLDN18.2 이중 항체로 최근 중국 임상에서 61% 종양을 억제하는 부분 관해 결과를 보였으며, 이 환자는 CLDN18.2 저발현 식도선암 환자로 저발현 환자군에서도 Grabody -T가 가능성을 보여줄 수 있을 것으로 판단한다.
저발현 환자군 시장은 최근 높은 관심을 받고 있는 시장으로 다이이찌산쿄/AZ의 ADC 약물인 엔허투의 HER2 low 유방암 환자 대상 임상인 DESTINY-Breast04에서 놀라운 결과를 통해 저발현 환자군 시장이라는 새로운 시장을 개척하고 있다. HER2 low 유방암 적응증에 대해서 FDA 승인 검토 시작 후 11일만에 허가 결정을 하는 이례적으로 빠른 허가를 보였다.
엔허투가 저발현 환자군에서 효과를 나타낸 이유로는 항체-링커-약물로 구성된 ADC 약물 구조에서 항체와 약물을 이어주는 링커가 암세포 내에서 분해된 후 자유로워진 약물(deruxtecan)이 주변의 HER2 발현이 극도로 낮은 종양 세포의 세포막을 자유롭게 투과해 종양 세포를 공격하는 bystander killing 효과로 인한 것으로 동사의 Grabody -T의 경우도 종양 세포 주변의 T-세포를 활성화된 후에 TAA 발현도가 낮은 종양 세포에 대해서도 효과를 유지할 것으로 생각하며 저발현 환자군에서 효과적이라면 가치 평가는 더욱 높아질 것이다.
그외 이중항체 플랫폼
[Grabody-I] 면역항암 이중항체 플랫폼으로서 두 가지 면역관문을 차단하는 기능을 가지고 있다. 기존의 PD-1 또는 PD-L1 기반 치료제는 낮은 반응률과 내성 발생이라는 문제를 가지고 있다. 그랩바디-I는 이러한 한계를 극복할 수 있는 새로운 치료 대안으로 세간의 주목을 받고 있다. T세포의 종양 살상기능을 회복시켜 기존 면역관문억제제의 반응률을 높이고, 환자들의 관해(Remission) 달성을 유도할 수 있기 때문이다.
그랩바디-I 플랫폼 기반의 '면역항암제 (ABL501)'는 최근 국가신약개발사업 과제로 선정됐다.
ABL501(PD-L1xLAG-3)은 그랩바디-I를 활용한 고형암 치료제 후보물질로, 두 가지 서로 다른 종류의 면역관문단백질인 LAG-3와 PD-L1을 타깃으로 한다. LAG-3 항체는 T세포의 종양 살상기능을 회복시킴으로써 기존 면역관문억제제의 반응률을 높이는 역할을 한다.
이미 글로벌 빅파마 BMS가 흑색종 환자 대상 LAG-3 항체 렐라틀리맙(Relatlimab)과 옵디보(Opdivo) 병용요법의 임상2·3상에서 LAG-3 억제제의 통계적 유의성을 확인한 바 있다. ABL501 역시 전임상에서 LAG-3 단독요법, PD-L1 단독요법 그리고 LAG-3와 PD-L1 병용요법 대비 개선된 항암효과를 입증했다.
현재 ABL501은 국내 임상 1상 코호트 2를 진행 중이며, 2023년에 임상 2상 시험계획서(IND) 신청 등의 단계에 돌입할 예정이다.
3. 기술의 사업화 전략
에이비엘바이오가 기술이전에 성공할 수 있었던 것은 퇴행성 뇌질환 및 면역항암 분야 기술에 대한 깊은 이해를 바탕으로 자사 파이프라인의 경쟁력을 부각할 수 있는 전략을 수립한 덕분이다. 국내외 콘퍼런스와 학회 참석, 비즈니스 미팅 등을 통해 빅파마들의 니즈를 이해하고, 글로벌에서의 경쟁 현황을 파악했다.
이에 지속적인 연구개발을 통해 매력적인 기술 데이터 Package를 만들고, 경쟁사가 아닌 자사의 기술이 파트너사와 가장 효율적인 시너지를 낼 수 있다는 점을 보여줬다. 기술이전 협상 역시 하나의 기업에만 집중하지 않고, 2개 이상의 기업과 지속적인 논의를 진행하며 이들 간의 경쟁 구도를 만들어 FOMO(Fear Of Missing Out) 효과를 이끌어내려 노력했다. 이러한 전략이 성공적으로 작용했고, 그 결과 이번과 같은 빅딜을 만들어낼 수 있었다.
ABL503 및 ABL111은 현재 미국에서 임상 1상이 진행되고 있다. ABL501도 국내 임상 1상 단계에 있으며, ABL105와 ABL101은 각각 올해 상반기 및 하반기에 IND를 제출을, ABL103(B7-H4x4-1BB)은 2023년에 IND를 제출할 예정이다.
또한 ADC(Antibody Drug-Conjugate) 치료제도 개발하고 있으며, ABL202는 파트너사에게 기술이전 돼 지속적인 연구 개발이 진행되고 있다. 현재 다수의 글로벌 빅파마와 협상을 진행하고 있으며, 이번에 빅딜을 성공시키면서 기술력이 검증돼 미팅 초기 단계를 건너뛰고 MTA(Material Transfer Agreement)부터 논의 중인 기업도 여러 곳이다.
에이비엘바이오의 글로벌 위상이 빅딜 이전과 확연히 달라졌으며, 미팅 분위기 역시 매우 우호적이기에 향후 긍정적인 성과가 기대된다.
신약 연구개발은 막대한 자금과 오랜 시간이 소요되는 일이다. 그래서 혁신 신약 창출과 글로벌 시장 진출 활성화를 위해서는 연구개발 모든 단계에서 밀착 지원이 필요하다. 국내 소규모 바이오벤처 중에는 인력 부족과 자금 문제로 연구개발에 어려움을 겪는 곳도 있다.
또한 초기 IND 신청 단계도 미국보다 복잡하다. 분석법 및 제조 방법 검증자료, 기준 설정 근거 자료 등은 미국 IND 진행 시 후기 단계에서 제출하면 되지만, 국내는 초기부터 필요해 IND 신청까지 오래 걸리는 경향이 있다.
특히 신약 개발에서 가장 중요한 것은 전문 연구 인력인 만큼, 제약바이오 분야 인재를 키우기 위한 국가적인 노력이 필요하다. 관련 학과와 대학원에 많은 투자가 이뤄져야 우수한 전문가들이 배출되고, 이들이 다시 바이오벤처나 제약사에서 신약 개발의 축이 되는 선순환 구조가 만들어질 수 있다.
https://www.youtube.com/watch?v=fcMnht0BENY
https://www.youtube.com/watch?v=TlB680ZUSsk
출처: 유안타증권, 에이비엘바이오, 약업신문, 뉴스투데이
뜨리스땅
https://tristanchoi.tistory.com/122
바이오 기업 탐구: 레고켐바이오
1. 기업 개요 레고켐바이오는 2006년에 설립되어 2013년 코스닥시장에 상장되었으며 의약화학을 기반으로 합성신약을 연구하고 개발하는 사업을 주로 영위하고 있는 기업이다. 신약개발 후보물질
tristanchoi.tistory.com
'바이오, 의학, 제약' 카테고리의 다른 글
| 바이오 기업 탐구: 미국 행정명령과 셀트리온 (1) | 2022.10.01 |
|---|---|
| 바이오 기업 실적 리뷰 2022 3Q: 삼성바이오, 셀트리온, SK바이오 등 (2) | 2022.09.10 |
| 의료기 기업 탐구: 제이시스메디칼 2022 3Q update (0) | 2022.09.02 |
| 바이오 기업 탐구: 셀트리온 update 2022 3Q (3) (0) | 2022.08.28 |
| 바이오 기업 탐구: 셀트리온 update 2022 3Q (2) (0) | 2022.08.28 |




댓글